Gilead je objavio dvogodišnje podatke iz ključne faze 3 studije koja procjenjuje Viread za kronični hepatitis B
Objavljeno
10 November, 2008.
u
Iz svijeta  Gilead Sciences je objavio prezentaciju dvogodišnjih (96 tjedana) podataka iz faze 3 ključnog kliničkog polusa, Studije 102 i 103, procjenjujući sigurnost i efikasnost jednom-dnevno Vireada (tenofovir disoproxil fumarate) među odraslim pacijentima sa kroničnom hepatitis B (HBV) virusnom infekcijom. Ovi podaci će biti prezentirani za vrijeme usmenog predavanja na godišnjem sastanku American Association for the Study of Liver Diseases (AASLD) koji se održava u San Francisku (Listopad 31-Studeni 4)
Gilead Sciences je objavio prezentaciju dvogodišnjih (96 tjedana) podataka iz faze 3 ključnog kliničkog polusa, Studije 102 i 103, procjenjujući sigurnost i efikasnost jednom-dnevno Vireada (tenofovir disoproxil fumarate) među odraslim pacijentima sa kroničnom hepatitis B (HBV) virusnom infekcijom. Ovi podaci će biti prezentirani za vrijeme usmenog predavanja na godišnjem sastanku American Association for the Study of Liver Diseases (AASLD) koji se održava u San Francisku (Listopad 31-Studeni 4)
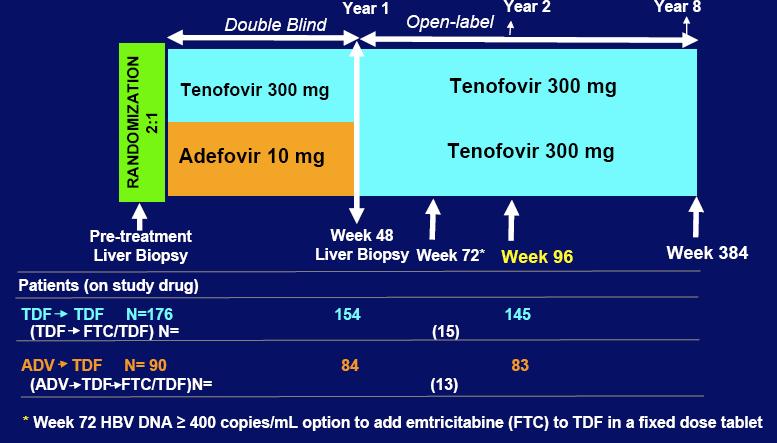
Studija 102 će procijeniti tretmam Vireadom u periodu do osam godina među pacijentima koji imaju HBeAg-negativni a studija 103 koji imaju HBeAg pozitivni kronični hepatitis B sa kompenziranim oboljenjem jetre. Pacijenti u obje studije su raspoređeni da nasumice primaju Viread ili Hepseru (adefovir dipivoxil). Nakon 48 tjedana nasumične slijepe terapije, svi pacijenti koji zadovoljavaju uvjete će biti prebačeni na otvorenu monoterapiju Vireadom.
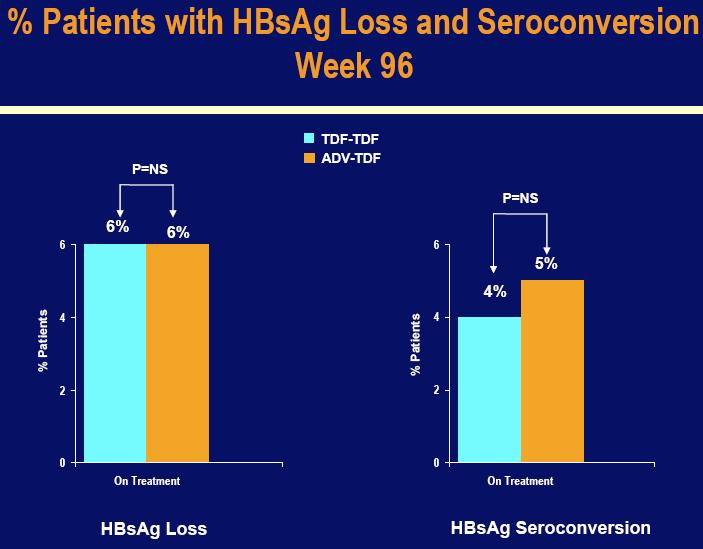
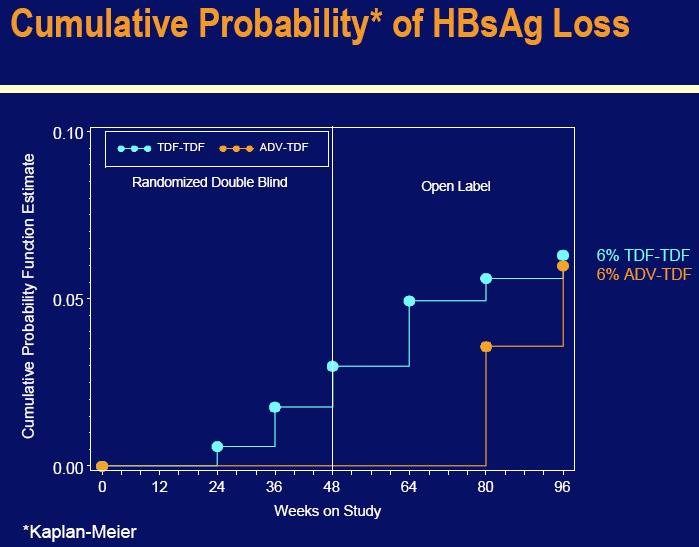
 Ovi novi podaci pokazuju kako su pacijenti koji su primali Viread do 98 tjedana, imali trajnu virusnu supresiju HBV nivoa u krvi (91% kod studije 102 i 78% kod studije 103). Studije također pokazuju da je kod svih pacijenata liječenih Hepserom čiji je HBV nivo potisnut u 48-om tjednu, zadržana virusna supresija nakon prebacivanja na Viread, dok su pacijenti liječeni sa Hepserom sa HBV DNA nivoom iznad 400 kopija/mL u 48-om tjednu imali značajnu virusnu supresiju nakon prebacivanja na Viread. Uz to, u 96-om tjednu studije 103, 6% od svih pacijenata na kontinuiranom tretmanu u obje grupe su imali gubitak „s“ antigena (HBsAg), koji pridinosi izliječenju kronične hepatitis B infekcije (omjer HBsAg serokonverzije je bio 4% među pacijentima koji su orginalno nasumično primali Viread i 5% kod pacijenata koji su se prebacili sa Hepsere).
Ovi novi podaci pokazuju kako su pacijenti koji su primali Viread do 98 tjedana, imali trajnu virusnu supresiju HBV nivoa u krvi (91% kod studije 102 i 78% kod studije 103). Studije također pokazuju da je kod svih pacijenata liječenih Hepserom čiji je HBV nivo potisnut u 48-om tjednu, zadržana virusna supresija nakon prebacivanja na Viread, dok su pacijenti liječeni sa Hepserom sa HBV DNA nivoom iznad 400 kopija/mL u 48-om tjednu imali značajnu virusnu supresiju nakon prebacivanja na Viread. Uz to, u 96-om tjednu studije 103, 6% od svih pacijenata na kontinuiranom tretmanu u obje grupe su imali gubitak „s“ antigena (HBsAg), koji pridinosi izliječenju kronične hepatitis B infekcije (omjer HBsAg serokonverzije je bio 4% među pacijentima koji su orginalno nasumično primali Viread i 5% kod pacijenata koji su se prebacili sa Hepsere).
Značajno je da nije prijavljena niti jedna mutacija povezana sa otpornošću na Viread među pacijentima koji primaju Viread monoterapiju do 96-og tjedna ili kod pacijenata liječenih sa Hepserom koji su se prebacili na Viread.
„U ovoj studiji Viread je predočio značajni stalni učinak kod dvogodišnjeg tretmana bez dokaza o otpornosti što je značajno kliničko otkriće,“ izjavio je dr. Patrick Marcellin, glavni istražitelj studije 102. „Uz to, pacijenti u ovoj studiji koji su uzimali Hepseru su bili prebačeni na Viread bez novih sigurnosnih pojava i bez kompromitiranja efikasnosti anti-HBV tretmana.“
Food and Drug Administration (FDA), je odobrila Viread za kronični HBV kod odraslih osoba u kolovozu 2008 bazirano na ranijim (48-tjednim) rezultatima ovih studija. Viread i Hepseru proizvodi Gilead.
„Jedno od najznačajnijih razmatranja kod liječenja kroničnog hepatitisa B je otpornost. Umirujuće je je vidjeti kako niti jedan pacijent iz oba dijela studije nije pokazao otpornost na Viread u 96 tjedana tretmana,“ izjavio je dr. Jenny Heathcote, glavni istražitelj studije 103. „Također je važno da je 6% HBeAg pozitivnih pacijenata imalo gubitak „s“ antigena.
O studijama 102 i 103
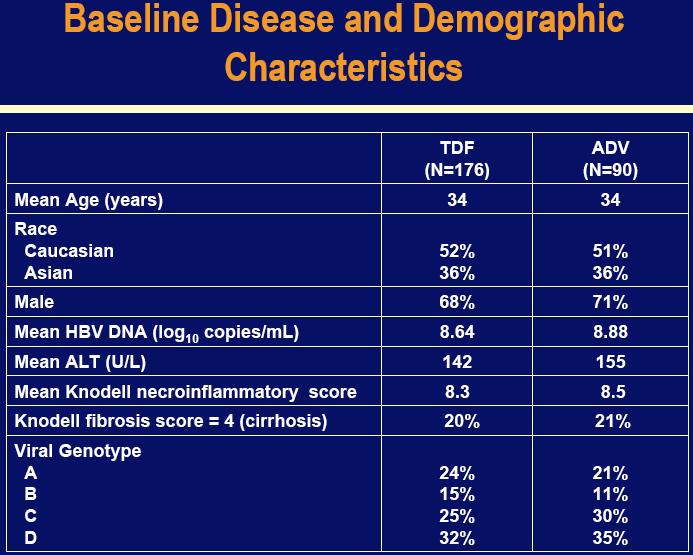
Studije 102 i 103 su bile multi-centralne, nasumične, dvostruko-slijepe faze III kliničkog ispitivanja usporedbe Vireada i Hepsere među pacijentima s kompenziranim jetrenim oboljenjem i HBsAg negativnim pretpostavljenim pre-core mutantima (n=375) i HBsAg pozitivnim (n=266) sa kroničnim hepatitisom B. Većina pacijenata je bila do sada ne liječena, iako su neki pacijenti (n=75) bili liječeni lamivudinom.
Pacijenti koji su nasumično primali Hepseru u obje studije su prebačeni na Viread (n=169) u 48-om tjednu, dok su pacijenti koji su originalno nasumično dobivali Viread nastavili tretman Vireadom u drugom 48-om tjednom tretmanu (n=389). Nakon 72 tjedna pacijenti s potvrđenom viremijom (nivo HBV DNA na, ili iznad 400 kopija/mL na dvije uzastopne kontrole) su imali opciju dodatka tretmanu emtricitabina u obliku Truvada, ispitnog proizvoda za liječenje kroničnog hepatitisa B.
Rezultati studije 102 (usmena prezentacija)
HBeAg negativni pacijenti
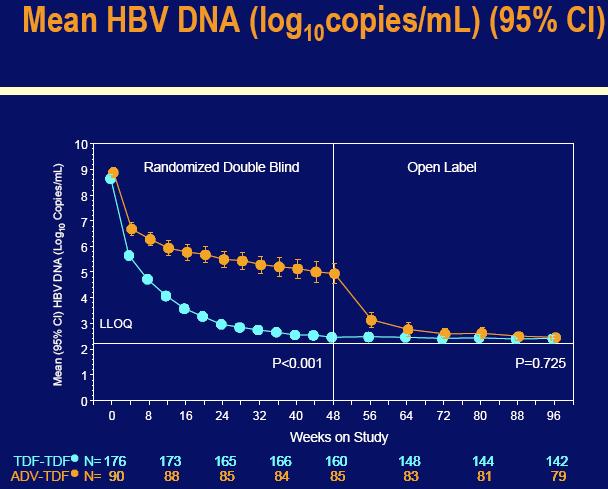
Korištenjem dugoročne evaluacije, algoritam analize s namjerom procjene kroz 96 tjedana, koji je isključio neke pacijente koji su prekinuli studiju zbog administrativnih razloga i koji su imali HBV DNA ispod 400 kopija/mL u zadnjem studijskom ispitivanju (n=7), 01% od onih koji su originalno nasumično dobijali Viread su postigli HBV DNA nivo ispod 400 kopij/mL u usporedbi sa 89% onih koji su originalno nasumično dobijali Hepseru i prebacili se na Viread u 48 tjednu (p=0.672).
Među pacijentima koji su dobijali Viread kroz svih 96 tjedana, 99% je postiglo HBV DNA nivo ispod 400 kopija/mL. Dodatno, svi pacijenti koji su se prebacili sa Hepsere na Viread u 48. tjednu, bez obzira da li su bili dobro kontrolirani pod Hepserom na viremiju, postigli su s Vireadom supresiju virusa na ispod 400 kopija/mL do 96-og tjedna.
Dva pacijenta u studiji 102 su dodala tratman emtricitabinom u obliku Truvada između 72. i 96. tjedna zbog potvrđene viremije. Jedan od ovih pacijenata je postigao virusnu supresiju do 96-og tjedna i ubraja se među onih 91% pacijenata koji su postigli stalnu supresiju s Vireadom kroz period od 96 tjedana.
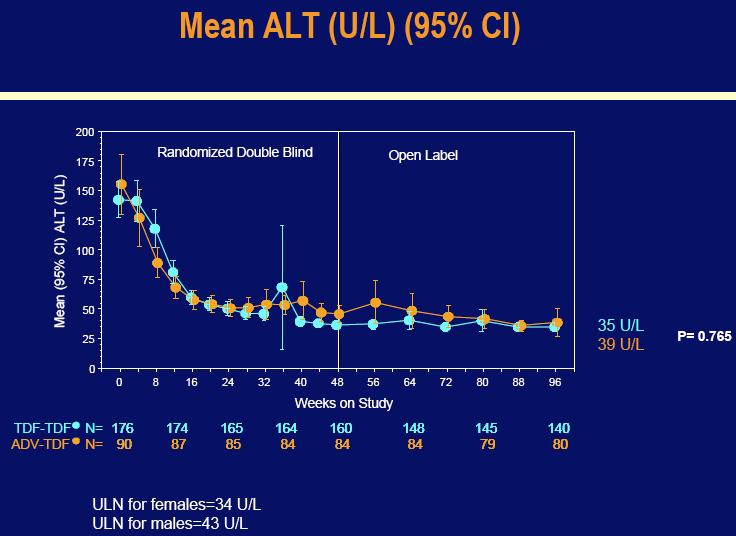
Nivo alanin aminotransferaza (ALT), koji je u početku bio visok, ostao je na skoro normalnom nivou između 48 i 96 tjedana tretmana u grupama Hepsere (35 U/L) i Hepsere-u-Viread (34 U/L) u 96-om tjednu.
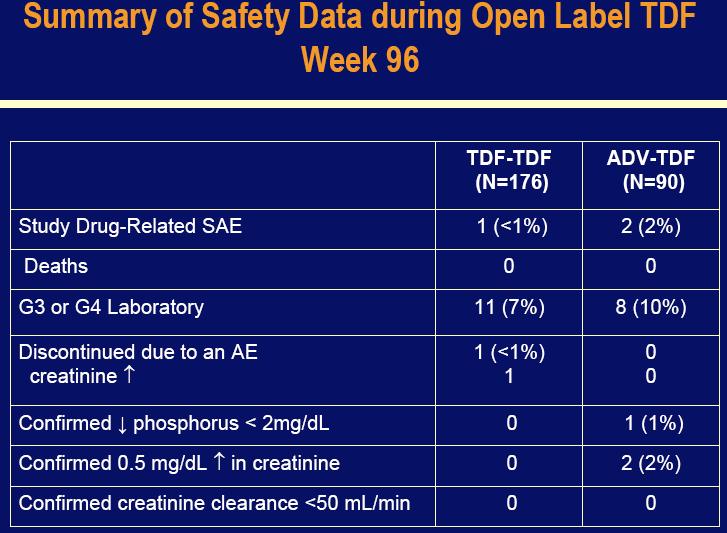
Viread je općenito bio dobro podnošen kod subjekata studija. Učestalost ozbiljnih nuspojava vezanih uz lijek je bila niska, sa jednim prijavljenim događajem u Viread grupi, i niti jednim prijavljenim u Hepsera-Viread grupi. U Viread grupi je bio jedan smrtni slučaj zbog metastatičkog karcinoma jetre, što je poznata komplikacija kronične hepatitis B infekcije. Učestalost 3-4 stupnja laboratorijskih nepravilnosti je bila 10% u obje, Viread i Hepsera-Viread grupama. Niti jedan pacijent nije imao potvrđeno 0.5 mg/L povećanje u serumu kreatinina, ili kreatinin klirensa od manje od 50 ml/min. Nije detektirana otpornost na Viread među pacijentima koji su dobijali monoterapiju Vireadom kroz dvije godine.
Rezultati studije 103 (usmena prezentacija #158)
HBeAg pozitivni pacijenti
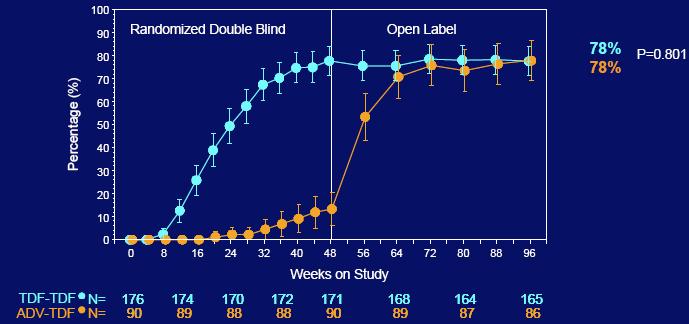
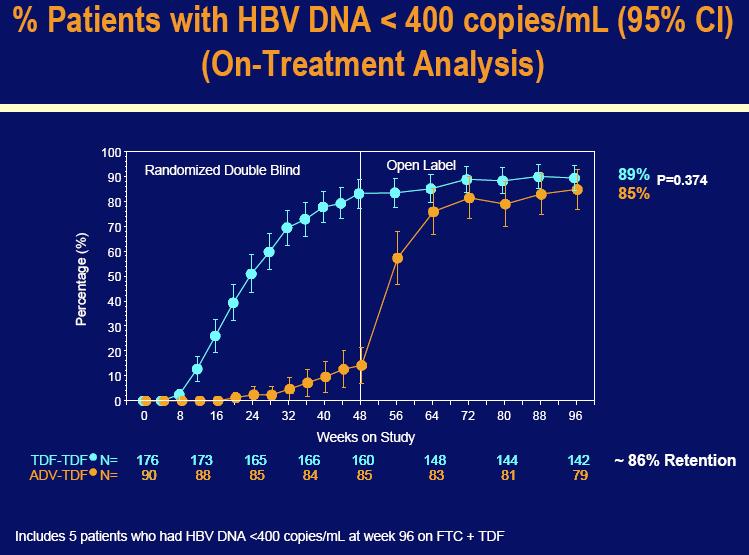
Korištenjem dugotrajne evaluacije, algoritma analize namjere liječenja kroz 96 tjedana, koja je isključila neke pacijente koji su prekinuli studiju zbog administrativnih razloga i imali su HBV DNA ispod 400 kopija/mL pri zadnjem studijskom ispitivanju (n=8), 78% onih koji su originalno nasumično dobijali Viread, postigli su HBV DNA nivo ispod 400 kopija/mL u usporedbi sa 78% onih koji su originalno nasumično dobijali Hepseru i prebacili se na Viread u 48-om tjednu (p=0.801).
Među pacijentima koji su dobijali Viread kroz svih 96 tjedana, 89% je postiglo HBV DNA nivo ispod 400 kopija/mL u usporedbi sa 85% pacijenata koji su ostali na Vireadu u 96-om tjednu nakon prebacivanja sa Hepsere u 48-om tjednu(p=0.374). Kao i u studiji 102, svi pacijenti koji su bili kontrolirani u 48-om tjednu na Hepseri (n=12) zadržali su virusnu supresiju nakon prebacivanja na Viread. Viremični pacijenti koji su dobijali Hepseru su imali rapidni odgovor nakon prebacivanja na Viread, od kojih je 82% postiglo HBV supresiju ispod 400 kopija/mL do 96-og tjedna.
28 pacijenata u Studiji 103 je dobilo emtricitabine tretman u obliku Truvada između 72 i96-og tjedna zbog potvrđene viremije. Petoro od ovih pacijenata je postiglo virusnu supresiju do 96-og tjedna od kojih se dvojica računaju među 78% pacijenta koji su doživili stalnu supresiju sa Vireadom kroz 96 tjedana, te trojica koja se računaju među 78% onih koji su postigli supresiju nakon prebacivanja sa Hepsere.
Kao i u studiji 102, nivo ALT koji je bio u početku povećan kod obje grupe pacijenata, ostao je stabilan na približno normalnom nivou do 96-og tjedna u obje grupe: Viread (39 U/L ) i Hepsera-u-Viread (39 U/L).
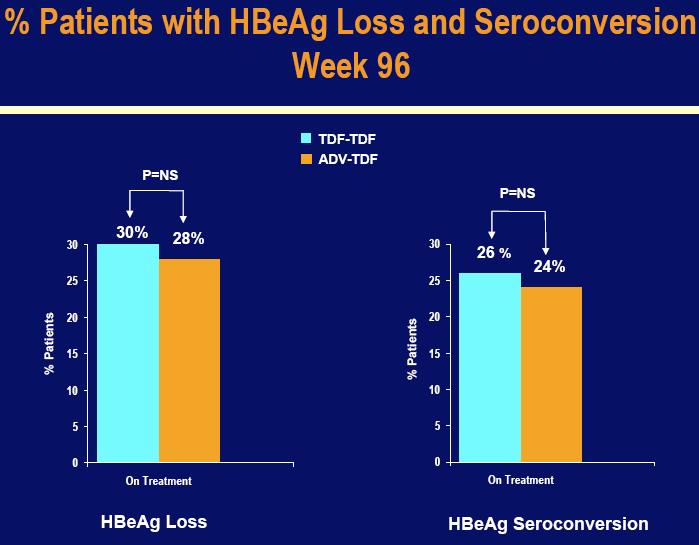
Među pacijentima koji su nastavili tretman do 96-og tjedna, HBeAg serokonverziju je doživjelosličan omjer pacijenata u grupama Viread (26%) i Hepsera – u –Viread (24%). Serokonverzija je definirana kao nestanak oba hepatitis B „e“ antigena, markera HBV replikacije (prikaz da je pacijent „HBe-antigen negativan“), te pojavljivanje specifičnih antitijela za ovaj antigen (prikaz da je pacijent pozitivan na „HBe-antitijela“). Dodatno, 6% pacijenata u obje tretirane grupe je imalo gubitak „s“ antigena (HBsAg) koji pridonosi izliječenju kronične hepatitis B infekcije (omjer HBsAg serokonverzije je bio 4% među pacijentima koji su originalno nasumično primali Viread i 5% kod pacijenata koji su se prebacili na Viread sa Hepsere).
Kao i u studiji 102, učestalost ozbiljnih nuspojava povezanih s lijekom je bila slična između Viread grupe (jedan pacijent) i Hepsera-u-Viread grupe (dva pacijenta). Učestalost 3-4 stupnja laboratorijskih nepravilnosti je također bila slična: 7% za pacijente samo sa Vireadom i 10% za pacijente u Hepsera-u-Viread grupi. Niti jedan pacijent nije doživio kreatinin klirens manje od 50 ml/min. Dva pacijenta u Hepsera-u-Viread grupi su imala potvrđeno 0.5mg/dL povećanje kreatinina u serumu u usporedbi sa niti jednim u Viread grupi. Kao i u studiji 102, nije nije detektiran niti jedan nastanak otpornosti među pacijentima koji su primali Viread kroz dvije godine.
Stalni tretman sa Vireadom kroz 96 tjedana nije otkrio niti jednu novu ozbiljnu reakciju niti promjenu u profilu podnošljivosti promatrano kroz prvih 48 tjedana tretmana. Ozbiljne nuspojave vezane uz tretman su primjećene kod više od 5% pacijenata za vrijeme prvih 48 tjedana studije 102 i 103 i uključuju: mučninu, bol u abdomenu, proljev, glavovolju, vrtoglavicu, umor, nazofaringitis, bol u leđima i kožni osip.









Izvor: www.natap.org, www.medicalnewstoday.com, originalni članak u skraćenom obliku možete pročitati ovdje



















